Inhoudsopgave
Elementen voor kinderen
Kwik
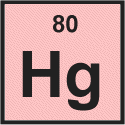 <--Gouden Thallium-- |
|
Kwik is het derde element in de twaalfde kolom van het periodiek systeem. Het wordt ingedeeld als overgangsmetaal. Kwikatomen hebben 80 elektronen en 80 protonen met 122 neutronen in de meest voorkomende isotoop.
Kenmerken en eigenschappen
Onder normale omstandigheden is kwik een glanzende, zware, zilverachtige vloeistof. Het is het enige metaal dat vloeibaar is bij kamertemperatuur. Bij kamertemperatuur verdampt het in de lucht.
Kwik is zeer giftig en kan door mensen worden opgenomen via de lucht, de huid of door het eten van voedsel met kwik. Een teveel aan kwik kan dodelijk zijn.
Wanneer kwik in contact komt met andere metalen, lost het deze op en vormt het een nieuwe stof die amalgaam wordt genoemd. IJzer is een van de weinige uitzonderingen en wordt daarom vaak gebruikt om kwik in op te slaan.
Waar komt het voor op aarde?
Kwik is een zeer zeldzaam element dat voorkomt in de aardkorst. Het wordt soms in vrije vorm gevonden, maar meestal in ertsen zoals cinnaber, livingstoniet en corderoiet. Het meeste kwik wordt tegenwoordig geproduceerd bij de winning van cinnaber, een helderrood erts.
Jarenlang waren Spanje en Italië de grootste producenten van kwik. Spanje delfde kwik om het te gebruiken bij de winning van zilver in Zuid-Amerika. Tegenwoordig wordt het meeste kwik gedolven in China en Kirgizië.
Hoe wordt kwik tegenwoordig gebruikt?
Kwik wordt gebruikt in een verscheidenheid van toepassingen, maar sommige daarvan worden geleidelijk afgeschaft vanwege gezondheidsproblemen. Vanwege zijn hoge dichtheid en thermische expansie wordt het gebruikt in meetinstrumenten zoals thermometers en barometers. Een belangrijke toepassing zijn tegenwoordig fluorescentielampen en kwikdamplampen.
Andere toepassingen van kwik zijn tandvullingen, telescopen, cosmetica en vaccins.
Hoe is het ontdekt?
Kwik is al bekend sinds de oudheid en werd gebruikt door beschavingen als het oude Egypte en het oude China. De eerste keizer van China, Qin Shi Huang, geloofde dat kwik deel uitmaakte van het levenselixer dat hem zou helpen eeuwig te leven. Helaas is kwik giftig en is het consumeren van kwik waarschijnlijk wat hem heeft gedood.
Jarenlang dachten alchemisten dat kwik de "prima materia" was en dat alle andere metalen uit kwik konden worden gemaakt. Ze dachten dat ze kwik konden gebruiken om goud te maken.
Hoe komt kwik aan zijn naam?
Mercurius ontleent zijn naam aan de planeet Mercurius, die werd genoemd naar de snelle boodschapper van de Romeinse goden, Mercurius. Het kreeg deze naam omdat het in zijn vloeibare vorm snel vloeide. Het symbool Hg komt van het Latijnse woord "hydragyrum" dat "vloeibaar zilver" betekent.
Isotopen
Kwik heeft zeven stabiele isotopen. De meest voorkomende in de natuur is kwik-202, dat ongeveer 30% van al het kwik bevat.
Interessante feiten over Mercurius
- Hoewel kwik het enige metaal is dat vloeibaar is bij kamertemperatuur, heeft het het kleinste vloeistofbereik van alle metalen. Het wordt een vaste stof bij -38,83°C en een gas bij 356,7°C.
- Sommige vissen, zoals zwaardvis en haai, kunnen hoge concentraties kwik bevatten.
- Het gebruik van kwik bij de productie is in verschillende landen, waaronder Noorwegen, Zweden en Denemarken, verboden.
- De term "gek als een hoedenmaker" komt van hoedenmakers die gek werden van het inademen van kwikdampen van chemicaliën die ze gebruikten bij het maken van hoeden.
- Houd kwik nooit in uw blote handen, want het kan door de huid sijpelen en u vergiftigen. Kwik mag niet in de open lucht worden achtergelaten, want het verdampt in de lucht en kan u vergiftigen door het in te ademen.
Meer over de elementen en het periodiek systeem
Elementen
Periodiek Systeem
| Alkalimetalen |
Lithium
Natrium
Kalium
Alkalische aardmetalen
Beryllium
Magnesium
Calcium
Radium
Overgangsmetalen
Scandium
Titanium
Vanadium
Chroom
Mangaan
Iron
Kobalt
Nikkel
Koper
Zink
Zilver
Platina
Goud
Kwik
Aluminium
Gallium
Tin
Lead
Metalloïden
Boron
Silicium
Germanium
Arsenicum
Niet-metalen
Waterstof
Koolstof
Stikstof
Zuurstof
Zie ook: Kids History: Underground RailroadFosfor
Zwavel
Fluor
Chloor
Jodium
Edelgassen
Helium
Neon
Argon
Lanthaniden en Actiniden
Uranium
Plutonium
Meer Chemie Vakken
| Materie |
Atom
Moleculen
Zie ook: Het oude Afrika voor kinderen: Koninkrijk Koesj (Nubië)Isotopen
Vaste stoffen, vloeistoffen, gassen
Smelten en koken
Chemische binding
Chemische reacties
Radioactiviteit en straling
Naamgeving van verbindingen
Mengsels
Mengsels scheiden
Oplossingen
Zuren en Basen
Kristallen
Metalen
Zouten en zepen
Water
Woordenlijst en termen
Chemische laboratoriumapparatuur
Organische Chemie
Beroemde chemici
Wetenschap>> Scheikunde voor kinderen>> Periodiek systeem


