Оглавление
Элементы для детей
Ртуть
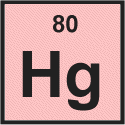 <---Золотой таллий---> |
|
Ртуть - третий элемент в двенадцатом столбце периодической таблицы. Она классифицируется как переходный металл. Атомы ртути имеют 80 электронов и 80 протонов с 122 нейтронами в наиболее распространенном изотопе.
Характеристики и свойства
При стандартных условиях ртуть представляет собой блестящую, тяжелую, серебристую жидкость. Это единственный металл, который находится в жидком состоянии при комнатной температуре. При комнатной температуре она испаряется в воздух.
Ртуть очень ядовита и может быть поглощена человеком через воздух, кожу или при употреблении пищи, содержащей ртуть. Слишком большое количество ртути может убить человека.
Когда ртуть вступает в контакт с другими металлами, она растворяет их и образует новое вещество, называемое амальгамой. Железо является одним из немногих исключений и поэтому часто используется для хранения ртути.
Где его можно найти на Земле?
Ртуть - очень редкий элемент, встречающийся в земной коре. Иногда он встречается в свободном состоянии, но обычно содержится в рудах, таких как киноварь, ливингстонит и кордероит. Большая часть ртути сегодня производится при добыче киновари, ярко-красной руды.
В течение многих лет Испания и Италия были крупнейшими производителями ртути. Испания добывала ртуть, чтобы использовать ее в процессе добычи серебра в Южной Америке. Сегодня большая часть ртути добывается в Китае и Кыргызстане.
Как сегодня используется ртуть?
Ртуть используется в различных сферах, но некоторые из них постепенно прекращают использовать из-за проблем со здоровьем. Из-за высокой плотности и характеристик теплового расширения она используется в измерительных приборах, таких как термометры и барометры. Основное применение сегодня - это люминесцентные лампы и лампы на парах ртути.
Другие области применения ртути включают зубные пломбы, телескопы, косметику и вакцины.
Как она была обнаружена?
Ртуть известна с древних времен и использовалась такими цивилизациями, как Древний Египет и Древний Китай. Первый император Китая, Цинь Шихуанди, верил, что ртуть является частью эликсира жизни, который поможет ему жить вечно. К сожалению, ртуть токсична, и употребление ртути, вероятно, привело к его смерти.
В течение многих лет алхимики считали, что ртуть является "prima materia" и что все другие металлы могут быть получены из ртути. Они думали, что с помощью ртути можно получить золото.
Откуда ртуть получила свое название?
Ртуть получила свое название от планеты Меркурий, которая была названа в честь быстрого вестника римских богов Меркурия. Такое название она получила потому, что в жидком состоянии быстро текла. Символ Hg происходит от латинского слова "hydragyrum", означающего "жидкое серебро".
Изотопы
Ртуть имеет семь стабильных изотопов. Наиболее распространенным в природе является ртуть-202, составляющая около 30% всей ртути.
Интересные факты о ртути
- Несмотря на то, что это единственный металл, который является жидким при комнатной температуре, ртуть имеет наименьший диапазон жидкостей среди всех металлов. Она превращается в твердое тело при -38,83°C и в газ при 356,7°C.
- Некоторые виды рыбы, такие как рыба-меч и акула, могут содержать большое количество ртути.
- Использование ртути в производстве было запрещено в нескольких странах, включая Норвегию, Швецию и Данию.
- Термин "безумный шляпник" произошел от шляпников, которые сходили с ума, вдыхая пары ртути от химических веществ, которые они использовали при изготовлении шляп.
- Никогда не держите ртуть в голых руках, так как она может просочиться через кожу и отравить вас. Ртуть нельзя оставлять на открытом воздухе, так как она испаряется в воздух и может отравить вас при дыхании.
Подробнее об элементах и периодической таблице
Элементы
Периодическая таблица
| Щелочные металлы |
Литий
Натрий
Калий
Щелочноземельные металлы
Бериллий
Магний
Кальций
Радий
Переходные металлы
Скандий
Титан
Ванадий
Хром
Марганец
Железо
Кобальт
Никель
Медь
Цинк
Серебро
Платина
Золото
Ртуть
Алюминий
Галлий
Олово
Вести
Металлоиды
Бор
Кремний
Германий
Мышьяк
Неметаллы
Водород
Углерод
Азот
Кислород
Фосфор
Смотрите также: Обзор истории и временной шкалы ИндииСера
Фтор
Хлор
Йод
Благородные газы
Гелий
Неон
Аргон
Лантаниды и актиниды
Уран
Плутоний
Другие предметы по химии
| Материя |
Атом
Молекулы
Изотопы
Твердые вещества, жидкости, газы
Плавление и кипение
Химическое связывание
Химические реакции
Смотрите также: Биография для детей: Дерек ДжитерРадиоактивность и радиация
Именование соединений
Смеси
Разделение смесей
Решения
Кислоты и основания
Кристаллы
Металлы
Соли и мыло
Вода
Глоссарий и термины
Оборудование для химической лаборатории
Органическая химия
Известные химики
Наука>> Химия для детей>> Периодическая таблица


