Spis treści
Elementy dla dzieci
Merkury
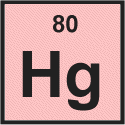 <---Gold Thallium---> |
|
Rtęć jest trzecim pierwiastkiem w dwunastej kolumnie układu okresowego.Jest klasyfikowany jako metal przejściowy.Atomy rtęci mają 80 elektronów i 80 protonów z 122 neutronów w najobficiej występującym izotopie.
Charakterystyka i właściwości
W standardowych warunkach rtęć jest błyszczącą, ciężką, srebrzystą cieczą.Jest to jedyny metal, który w temperaturze pokojowej jest cieczą.W temperaturze pokojowej wyparuje do powietrza.
Rtęć jest bardzo trująca i może być wchłaniana przez ludzi poprzez powietrze, skórę lub poprzez spożywanie żywności zawierającej rtęć. Zbyt duża ilość rtęci może zabić człowieka.
Kiedy rtęć wchodzi w kontakt z innymi metalami, rozpuszcza je i tworzy nową substancję zwaną amalgamatem. Żelazo jest jednym z niewielu wyjątków i w związku z tym jest często używane do przechowywania rtęci.
Gdzie można ją znaleźć na Ziemi?
Rtęć jest bardzo rzadkim pierwiastkiem występującym w skorupie ziemskiej. Czasami występuje w stanie wolnym, ale zazwyczaj znajduje się w rudach, takich jak cynober, livingstonit i corderoit. Większość rtęci jest dziś produkowana w wyniku wydobycia cynobru, jasnoczerwonej rudy.
Przez wiele lat Hiszpania i Włochy były największymi producentami rtęci. Hiszpania wydobywała rtęć, aby wykorzystać ją w procesie wydobycia srebra w Ameryce Południowej. Obecnie większość rtęci wydobywa się w Chinach i Kirgistanie.
Jak dziś wykorzystuje się rtęć?
Rtęć jest wykorzystywana w wielu zastosowaniach, ale z niektórych z nich jest wycofywana ze względu na kwestie zdrowotne. Ze względu na dużą gęstość i właściwości rozszerzalności cieplnej jest wykorzystywana w przyrządach pomiarowych, takich jak termometry i barometry. Obecnie głównym zastosowaniem są lampy fluorescencyjne i lampy z parami rtęci.
Inne zastosowania rtęci to wypełnienia dentystyczne, teleskopy, kosmetyki i szczepionki.
Jak to zostało odkryte?
Rtęć jest znana od czasów starożytnych i była używana przez cywilizacje takie jak starożytny Egipt i starożytne Chiny. Pierwszy cesarz Chin, Qin Shi Huang, wierzył, że rtęć jest częścią Eliksiru Życia, który pomoże mu żyć wiecznie. Niestety, rtęć jest toksyczna i spożywanie rtęci jest prawdopodobnie tym, co go zabiło.
Przez wiele lat alchemicy uważali, że rtęć jest "prima materia" i że z rtęci można zrobić wszystkie inne metale. Sądzili, że z rtęci można zrobić złoto.
Skąd rtęć wzięła swoją nazwę?
Merkury otrzymuje swoją nazwę od planety Merkury, która została nazwana na cześć szybkiego posłańca rzymskich bogów, Merkurego. Otrzymał on tę nazwę, ponieważ szybko płynął w swojej płynnej formie. Symbol Hg pochodzi od łacińskiego słowa "hydragyrum" oznaczającego "płynne srebro".
Izotopy
Rtęć posiada siedem stabilnych izotopów. Najobficiej występującym w przyrodzie jest rtęć-202, która stanowi około 30% całej rtęci.
Ciekawe fakty o rtęci
- Pomimo tego, że jest jedynym metalem, który jest cieczą w temperaturze pokojowej, rtęć ma najmniejszy zakres cieczy ze wszystkich metali. Staje się ciałem stałym w temperaturze -38,83°C, a gazem w temperaturze 356,7°C.
- Niektóre ryby, takie jak miecznik i rekin, mogą zawierać duże ilości rtęci.
- Stosowanie rtęci w produkcji zostało zakazane w kilku krajach, w tym w Norwegii, Szwecji i Danii.
- Termin "szalony jak kapelusznik" pochodzi od producentów kapeluszy, którzy oszaleli wdychając opary rtęci z chemikaliów, których używali do produkcji kapeluszy.
- Nigdy nie trzymaj rtęci w gołych rękach, ponieważ może ona przesiąknąć przez skórę i zatruć Cię. Rtęci nie należy pozostawiać na wolnym powietrzu, ponieważ wyparuje ona do powietrza i może Cię zatruć poprzez jej wdychanie.
Więcej o pierwiastkach i układzie okresowym
Elementy
Układ okresowy
| Metale alkaliczne |
Lit
Sód
Potas
Metale ziem alkalicznych
Beryl
Magnez
Wapń
Rad
Metale przejściowe
Scandium
Tytan
Wanad
Chrom
Mangan
Iron
Kobalt
Nikiel
Miedź
Cynk
Srebrny
Platinum
Złoto
Zobacz też: Prawa obywatelskie dla dzieci: Ustawa o prawach obywatelskich z 1964 r.Merkury
Aluminium
Gallium
Tin
Lead
Metaloidy
Bor
Krzem
Germania
Arsen
Niemetale
Wodór
Węgiel
Azot
Tlen
Fosfor
Siarka
Fluor
Chlor
Jod
Gazy szlachetne
Hel
Neon
Argon
Lantanowce i aktynowce
Uran
Pluton
Więcej przedmiotów z chemii
| Materia |
Atom
Molekuły
Izotopy
Ciała stałe, ciecze, gazy
Topnienie i wrzenie
Wiązanie chemiczne
Reakcje chemiczne
Radioaktywność i promieniowanie
Nazewnictwo związków
Mieszanki
Rozdzielanie mieszanin
Rozwiązania
Kwasy i zasady
Kryształy
Metale
Sole i mydła
Woda
Słowniczek i terminy
Wyposażenie laboratorium chemicznego
Chemia organiczna
Słynni chemicy
Nauka>> Chemia dla dzieci>> Układ okresowy


